在高中及大學普化的範圍內,一個分子是否為平面分子的問題,通常是以有沒有可旋轉單鍵的存在與否來決定,不過卻出現了一個很有意思的例子-丙二烯
首先,讓我們來看看其結構式:
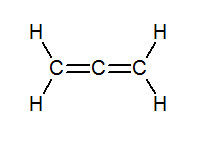
顯而易見,其左邊與右邊碳為sp2混成,中間碳為sp混成,在高中的討論範圍內應該要屬於平面分子,但實際上,它卻是非平面分子!到底發生了甚麼事?我們可始試著從其混成軌域的方向來開始簡單的討論。
一般來說,碳的價軌域為2s、2p軌域,而2p軌域又可分為2px、2py、2pz三個方向,而形成丙二烯時,常見的討論過程如下:
首先,我們先利用這張圖做一個假設:
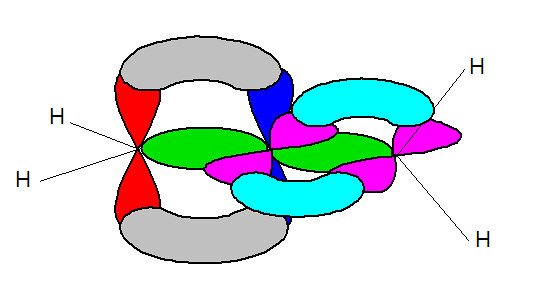
(1)左邊碳:利用2s、2px、2py形成3個sp2混成軌域,而留下2pz(紅色)作為形成π鍵所需軌域,其中1個與中間碳形成σ單鍵(綠色),而剩餘的2個則外接氫原子,此時氫原子在x-y平面上
(2)中間碳:利用2s、2px形成2個sp混成軌域,與左邊碳及右邊碳之sp2軌域頭對頭(head to head)形成σ單鍵(綠色);再利用2pz(藍色)與左邊碳的2pz形成π鍵(灰色);最後留下2py(粉紅色)做為與右邊碳形成π鍵所需軌域。
(3)右邊碳:此時為了與中間碳形成π鍵,其2py(粉紅色)不能參與混成,所以由2s、2px、2pz形成3個sp2混成軌域,其中1個與中間碳形成σ單鍵(綠色),而剩餘的2個外接氫原子,此時氫原子在x-z平面上。
我們拿(1)、(3)做比較,可以發現左邊碳的氫原子在x-y平面上;但右邊碳的氫原子在x-z平面上,兩者個氫原子是在不同平面上的,是故我們說丙二烯並不是一個共平面分子,夠神奇吧!


 留言列表
留言列表

